Wikigeotech:Le bleu de méthylène : Différence entre versions
(→L'orientation de la molécule de bleu sur les surfaces) |
|||
| Ligne 38 : | Ligne 38 : | ||
Le plan qui caractérise les groupements hétéro-aromatiques de la molécule de MB n'est pas toujours disposé parallèlement à la surface de l’argile comme supposé dans les études antérieures (Pham and Brindley, 1970) mais plutôt de manière inclinée ou perpendiculaire sur les argiles (Kaneko, 2003 ; Kobayashi, 1996 ; Bujdak, 2003) ou sur les films de Langmuir-Blodgett à base d’argile (Umemura, 2003). La molécule est orientée de manière à ce que sa charge positive soit tournée vers la surface négative de l'argile (voir figure ci-dessous). | Le plan qui caractérise les groupements hétéro-aromatiques de la molécule de MB n'est pas toujours disposé parallèlement à la surface de l’argile comme supposé dans les études antérieures (Pham and Brindley, 1970) mais plutôt de manière inclinée ou perpendiculaire sur les argiles (Kaneko, 2003 ; Kobayashi, 1996 ; Bujdak, 2003) ou sur les films de Langmuir-Blodgett à base d’argile (Umemura, 2003). La molécule est orientée de manière à ce que sa charge positive soit tournée vers la surface négative de l'argile (voir figure ci-dessous). | ||
| − | [[File:orientation MB.png|400px|thumbs|Orientation des molécules de MB sur diverses surfaces | + | [[File:orientation MB.png|400px|thumbs|Orientation des molécules de MB sur diverses surfaces]] |
| − | + | [[File:orientation MB seule.png|100px]] | |
| − | + | ||
| − | [[File:orientation MB seule.png| | + | |
| − | + | Cette figure illustre l'orientation des molécules de MB sur diverses surfaces (Bujdak, 2003) : | |
| − | + | * a - à gauche : Arrangement des molécules adsorbée dont la grande surface (plan ab) est perpendiculaire par rapport à la surface du minéral et inclinée avec une rotation par rapport à l’axe c (configuration très répandue dans la littérature) ; | |
| − | + | * a - à droite : Orientation classique avec la grande surface (plan ab) de la molécule parallèle à la surface du minéral ; | |
| − | + | * b : Arrangement face contre face des faces (ab) des molécules inclinées à l’image des tuiles sur un toit, | |
| − | + | * c : Orientation inclinée avec un tilt autour des axes moléculaires. | |
| − | + | ||
| − | + | ||
| + | De plus, tout en gardant le plan moléculaire du colorant perpendiculaire par rapport au plan de la surface de l'argile, l'axe longitudinal de la molécule de MB peut être non parallèle ou incliné à de faibles angles par rapport au plan de surface de l'argile (Bujdak et al., 2003). <br /> | ||
| + | |||
| + | Seule l'orientation inclinée sur la Figure (a) est adaptée pour former en même temps des agrégats de MB de grande taille sur les surfaces et pour fournir une interaction électrostatique entre la surface chargée négativement de l’argile et chaque site cationique du colorant adsorbé. <br /> | ||
| + | Plusieurs articles ont été publiés sur l'orientation de la molécule de MB adsorbée sur différents types de surfaces non-argileuses. Essentiellement, c’est une orientation moléculaire de MB parallèle à la surface qui a été observée. Dans le cas des argiles par contre, l'angle d’inclinaison de la molécule de MB est modifié par la charge des feuillets argileux, et l'interaction électrostatique entre la surface chargée négativement des argiles et le groupe chargé positivement de la molécule de MB joue probablement un rôle majeur (Bujdak, 2008). Pour illustration, la spectroscopie de photoélectrons XPS et la technique XANES (qui signifie X-ray Absorption Near Edge Structure soit en français Spectroscopie de structure près du front d'absorption de rayons X), toutes deux réalisées avec un faisceau polarisé, montrent de manière directe que les molécules de MB sont inclinées à un angle d'environ 65-70° par rapport au plan de surface du mica (Hähner et al. 1996). La densité de charge élevée sur les surfaces de mica pourrait contribuer à la forte densité de colorant cationique adsorbé et, ainsi, accroître l’angle d'orientation moyen des molécules. | ||
= Préparation de la solution de bleu de méthylène = | = Préparation de la solution de bleu de méthylène = | ||
Version du 18 janvier 2021 à 18:13
Le bleu de méthylène est un composé chimique utilisé dans le domaine de la géotechnique (NF P94-068) et des granulats (NF EN 933-9) pour déterminer la valeur de bleu de méthylène par l'essai à la tache, essai couramment utilisé en France pour quantifier la fraction argileuse contenue dans un matériau.
Sommaire |
La molécule de bleu
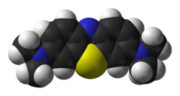
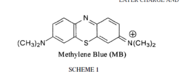
Le bleu de méthylène (ou chlorure de méthylthioninium) est un composé chimique aromatique hétérocyclique de formule moléculaire C16H18N3SCl avec une configuration géométrique rectangulaire plane de dimensions 17Å x 7.6 Å x 3.25 Å (voir Figure).
A température ambiante, il apparaît sous forme d’une poudre solide vert foncée inodore. Le bleu de méthylène qui est un colorant cationique (cationic dye), donne une solution bleue une fois dissous dans l'eau. La forme hydratée de la molécule dispose de 3 molécules d'eau par molécule de bleu.
Propriétés de la molécule de bleu de méthylène
La molécule de bleu de méthylène a la propriété de s'adsorber très facilement sur les surfaces des particules chargée négativement, ce qui est le cas des argiles.
L’interaction entre le bleu de méthylène (ou Methylen Blue en anglais, ou MB) et les composants du sol ou des roches a été largement étudiée pendant une longue période au sein du LCPC (actuellement Université Gustave Eiffel) (Tran, 1979 ; Youssefian, 1989). Ces travaux mettent en évidence l'efficacité du bleu de méthylène en tant que colorant pour quantifier les phases hydrophiles contenues dans les sols telles que l'argile, les oxydes ou les silicates ferreux hydratés. Or l'argile peut avoir un impact sur les caractéristiques géotechniques et induire une diminution de certaines performances mécaniques lorsque le matériau est en présence d'eau.
Les travaux se sont donc orientés vers la recherche d'une corrélation entre l’adsorption de la molécule de MB (en g/100 g) et les mesures de surface spécifique (mesure par adsorption d’EGME par exemple), corrélation démontrée dès 1950 par Dyal (1950).
Sachant que la molécule de bleu se présente sous la forme d’un parallélépipède dont les deux plus grands cotés mesurent respectivement 17Å et 7.6 Å (ce qui donne une surface de 130 Å2/ molécule - Pham et Brindley, 1970), une relation simple relie proportionnellement la quantité de MB adsorbé sur le matériau à la surface active de ce dernier (indirectement la quantité d'argile dite nocive pour un bon comportement avec l'eau).
Ce calcul est cependant basé sur deux hypothèses fondamentales :
- les molécules de bleu s’adsorbent sous forme de monomères (non agrégés) sur la surface du matériau,
- les molécules de bleu s’adsorbent de manière à ce que leur plus grande surface soit parallèle à la surface de l’argile.
Ces hypothèses peuvent s’avérer fausses dans certains cas (pour certaines argiles) et vraies dans d’autres. La mesure de la valeur de bleu n’est pas toujours corrélée de manière simple à la surface spécifique (totale) du matériau, que l’on suppose proportionnelle à la quantité des fines argileuses présentes.
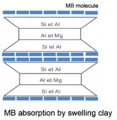
L'adsorption des molécules de bleu à la surface des argiles
Les argiles sont des minéraux complexes, de forme et de composition très variées. Le bleu de méthylène a la particularité de s'adsorber à la surface de ces particules. Selon la charge de l’argile, les molécules de bleu vont s'adsorber sur la surface spécifique avec une orientation et/ou une agrégation qui peut perturber le calcul de la surface spécifique des argiles.
L'hypothèse la plus commune, est de considérer que le MB va s'adsorber sur la surface des particules sous la forme de monomères en monocouche.
Dans certains cas, la molécule peut être inclinée à 65 à 70° par rapport à la surface de l’argile (configuration de type « tuiles ») et non plus adsorbée parallèlement à la surface de la particule. Ainsi, la zone couverte est de 65 Å2/ molécule au lieu de 130 Å2/ molécule ce qui modifie le calcul de la surface spécifique.
Les agrégats de molécules de bleu de méthylène
L'orientation de la molécule de bleu sur les surfaces
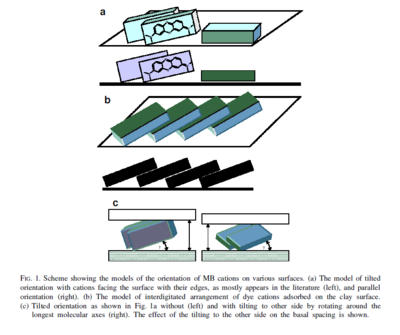
Le plan qui caractérise les groupements hétéro-aromatiques de la molécule de MB n'est pas toujours disposé parallèlement à la surface de l’argile comme supposé dans les études antérieures (Pham and Brindley, 1970) mais plutôt de manière inclinée ou perpendiculaire sur les argiles (Kaneko, 2003 ; Kobayashi, 1996 ; Bujdak, 2003) ou sur les films de Langmuir-Blodgett à base d’argile (Umemura, 2003). La molécule est orientée de manière à ce que sa charge positive soit tournée vers la surface négative de l'argile (voir figure ci-dessous).
Cette figure illustre l'orientation des molécules de MB sur diverses surfaces (Bujdak, 2003) :
- a - à gauche : Arrangement des molécules adsorbée dont la grande surface (plan ab) est perpendiculaire par rapport à la surface du minéral et inclinée avec une rotation par rapport à l’axe c (configuration très répandue dans la littérature) ;
- a - à droite : Orientation classique avec la grande surface (plan ab) de la molécule parallèle à la surface du minéral ;
- b : Arrangement face contre face des faces (ab) des molécules inclinées à l’image des tuiles sur un toit,
- c : Orientation inclinée avec un tilt autour des axes moléculaires.
De plus, tout en gardant le plan moléculaire du colorant perpendiculaire par rapport au plan de la surface de l'argile, l'axe longitudinal de la molécule de MB peut être non parallèle ou incliné à de faibles angles par rapport au plan de surface de l'argile (Bujdak et al., 2003).
Seule l'orientation inclinée sur la Figure (a) est adaptée pour former en même temps des agrégats de MB de grande taille sur les surfaces et pour fournir une interaction électrostatique entre la surface chargée négativement de l’argile et chaque site cationique du colorant adsorbé.
Plusieurs articles ont été publiés sur l'orientation de la molécule de MB adsorbée sur différents types de surfaces non-argileuses. Essentiellement, c’est une orientation moléculaire de MB parallèle à la surface qui a été observée. Dans le cas des argiles par contre, l'angle d’inclinaison de la molécule de MB est modifié par la charge des feuillets argileux, et l'interaction électrostatique entre la surface chargée négativement des argiles et le groupe chargé positivement de la molécule de MB joue probablement un rôle majeur (Bujdak, 2008). Pour illustration, la spectroscopie de photoélectrons XPS et la technique XANES (qui signifie X-ray Absorption Near Edge Structure soit en français Spectroscopie de structure près du front d'absorption de rayons X), toutes deux réalisées avec un faisceau polarisé, montrent de manière directe que les molécules de MB sont inclinées à un angle d'environ 65-70° par rapport au plan de surface du mica (Hähner et al. 1996). La densité de charge élevée sur les surfaces de mica pourrait contribuer à la forte densité de colorant cationique adsorbé et, ainsi, accroître l’angle d'orientation moyen des molécules.
Préparation de la solution de bleu de méthylène
Selon l'annexe A de la norme NF P94-068 (et presque en tout point identique à l'annexe C de la norme NF EN 933-9 pour l'essai des granulats), la préparation doit être réalisée très précisément selon le protocole suivant :
- Utiliser de l'eau déminéralisée ou distillée.
- Utiliser du bleu de méthylène, de qualité pharmaceutique référence CODEX, degré de pureté ≥ 98,5 %, présenté sous forme de poudre et conditionné en flacon.
- Déterminer la teneur en eau de la poudre de bleu de méthylène contenue dans le flacon, sur un échantillon d'environ 5 g ; l teneur en eau doit être déterminée pour la préparation de chaque nouveau bain de solution.
- Verser 500 g à 700 g d'eau déminéralisée ou distillée dans le récipient. Si on utilise de l'eau chaude la température ne doit pas excéder 50 °C (40°C pour la norme NF EN 933-9) ;
- Prendre une masse de poudre de bleu de méthylène de (10 (1 + w) ± 0,01) g soit l'équivalent de 10 g de poudre sèche ;
- Agiter le contenu du récipient en ajoutant lentement la poudre de bleu de méthylène dans l'eau. Vérifier la complète dissolution de la poudre et si elle n'est pas atteinte poursuivre l'agitation ;
- Compléter la masse de la solution avec de l'eau déminéralisée ou distillée jusqu'à une masse totale de solution de (1 000 ± 5) g puis agiter la solution pendant au moins 5 min. Dans le cas où on utilise une fiole jaugée de 1 litre, compléter avec de l'eau déminéralisée ou distillée jusqu'au trait repère en s'assurant que la température de la solution soit proche de (20 ± 1) °C ;
- Conserver la solution ainsi préparée dans une bouteille de conservation fermée (en verre teinté de préférence) et placée à l'abri de la lumière. La solution de bleu de méthylène ne doit pas être utilisée plus d'un mois après sa préparation (28 jours dans la norme NF EN 933-9).
Les indications suivantes doivent figurer sur la bouteille de conservation :
- nature du contenu : solution de bleu de méthylène à 10 g/l ;
- date de préparation : ................................................ ;
- date limite d'utilisation : ........................................... ;
La solution périmée peut être évacuée dans le tout-à-l'égout car elle ne présente aucune nocivité pour l'environnement. Elle présente néanmoins l'inconvénient de fortement tacher les surfaces.
 S'abonner à un flux RSS
S'abonner à un flux RSS